O Método de Kjeldahl e como reduzir os custos da análise de nitrogênio e proteína
A determinação de proteínas através do Nitrogênio Total foi proposta em 1883 por Johann Kjeldahl, um químico dinamarquês, que descobriu um processo para determinar nitrogênio em matéria orgânica, que é até hoje considerada um método confiável para determinação indireta de proteínas em alimentos ou de nitrogênio em solo e plantas, e ele permanece em uso apesar de algumas modificações.
O método acontece em três etapas distintas: digestão da amostra, por ação de ácido sulfúrico concentrado com catalisador para acelerar a etapa, destilação do nitrogênio e, por fim, destilação ácida.
Mesmo sendo um método bem descrito e aceito, é muito discutido nos dias de hoje como reduzir a quantidade de produtos químicos liberados no meio ambiente, tendo em vista as políticas ambientais. Uma das estratégias recomendadas é substituir ou diminuir as quantidades de reagentes, ou ainda, modificar os procedimentos completamente.
Alguns estudos já comparam o método de Kjeldahl com outros métodos de determinação de proteínas, como a Espectroscopia NIR ou o método de Dumas.
Neste artigo discutiremos a respeito da análise usando o método de Kjeldahl, reduzindo o uso de regentes, e apresentaremos métodos alternativos, assim como falaremos sobre seus aspectos positivos e negativos.
O Método de Kjeldahl
Parte Experimental Materiais e Equipamentos
- Bloco digestor;
- Capela para exaustão de gases;
- Destilador de nitrogênio;
- Bureta automática;
- Agitador magnético;
- Erlenmeyer de 50 mL;
- Balança analítica – precisão (± 0,0001g);
- Tubo de ensaio com borda reforçada (25×250 mm);
- Frascos dosadores de reagente;
- Espátula;
- Papel impermeável.
Reagentes e Soluções
- Ácido sulfúrico (H2SO4 – d=1,84), p.a., concentrado;
- Hidróxido de sódio (NaOH) a 40% (m/v);
- Sulfato de sódio (Na2SO4);
- Sulfato de cobre penta hidratado (CuSO4.5H2O);
- Ácido clorídrico (HCl) 0,01 mol/L;
- Vermelho de metila a 0,04% (m/v);
- Solução de ácido bórico, a 2% (m/v).
- Solução alcoólica de:
- Verde de bromocresol, a 0,1% (m/v);
- Vermelho de metila a 0,1% (m/v);
- Vermelho de metila a 0,04% (m/v);
Quantidade de reagentes
Mistura Catalisadora
A mistura catalisadora é feita com 1000g de Sulfato de Sódio Anidro para 50g de Sulfato de Cobre Penta hidratado, na metodologia tradicional é usado também 2,5g de Selênio em pó, mas a fim de minimizar a geração de resíduos optou-se por não usar o Selênio.
Solução Receptora Indicadora
Misturar 1000 mL de solução de ácido bórico a 2%, 6 mL de solução alcoólica de vermelho de metila a 0,1% e 15 mL de solução alcoólica de verde de bromocresol.
Procedimento:
Digestão
Para a etapa de digestão foi pesou-se a amostra, em um tubo digestor micro-Kjeldahl, adicionou-se a mistura catalisadora e o Ácido Sulfúrico P.A. cuidadosamente pela parece do frasco. Em seguida a amostra segue para digestão em um bloco digestor, com elevação gradual da temperatura até 400°C por cerca de 3 horas.
Durante essa etapa, o carbono contido na matéria orgânica é oxidado e o dióxido de carbono (CO2) se desprende. Durante o processo da digestão a solução passa de uma coloração escura (preto) para um verde claro, que é indicativo do fim da reação. Após essa etapa é adicionado água e esperado até o resfriamento da amostra.

Destilação
Em seguida inicia-se o processo de destilação, que pode ser feita por aquecimento direto ou por arraste de vapor. O Sulfato de amônio obtido na última etapa, é tratado com NaOH, em excesso, que libera a amônia. O nitrogênio da amostra é, então, recolhido em um erlenmeyer contendo solução de ácido bórico e com a solução receptora indicadora. O processo é finalizado quando toda a amônia se desprendeu, isso é sinalizado observando a mudança de coloração da solução de rosa para azul.
Titulação
Por fim, é realizada a titulação, em que o borato de amônio é titulado com uma solução de HCl, até que ocorrer a viragem do indicador, que adquire uma coloração rosa clara.

Determinação do Nitrogênio Total:
O nitrogênio total (NT) é determinado pela seguinte equação:
NT = (Va – Vb) x F x 0,1 x 0,014 x 100 / P1
Onde: NT – teor de nitrogênio total na amostra, em percentagem;
Va – volume da solução de ácido clorídrico gasto na titulação da amostra, em mililitros;
Vb – volume da solução de ácido clorídrico gasto na titulação do branco, em mililitros;
F – fator de correção para o ácido clorídrico 0,01 mol/L;
P1 – massa da amostra (em gramas).
Determinação da Proteína Bruta:
Na determinação da proteína bruta, multiplica-se o valor do nitrogênio total encontrado pelo método de Kjeldahl por um fator que converte o nitrogênio em proteína. Convencionalmente, em amostras de alimentos para animais: plantas forrageiras, rações concentradas, entre outros materiais, a proteína bruta (PB) é expressa pelo fator 6,25, considerando que a maioria das proteínas contém nas suas moléculas aproximadamente 16% de nitrogênio.
É usada a expressão abaixo para determinação da Proteína Bruta:
PB = NT x FN
Onde:
PB – Teor de proteína bruta na amostra, em percentagem;
FN – 6,25.
Para feijão preto e soja, pode se usar um FN: 5,71 e para leite FN: 6,38.
Conclusão
O estudo concluiu que a nova metodologia proposta possibilitou atingir os objetivos específicos do trabalho: diminuir a quantidade de resíduos gerados, o consumo de reagentes e os custos para a determinação de nitrogênio total e proteína bruta pelo método Kjeldhal. Além disso, foi verificado que as alterações nas quantidades dos reagentes proposta neste método não influenciaram significativamente nos resultados e na precisão dele. Diante destes resultados, esta metodologia passou a ser adotada como análise padrão pela Embrapa Pantanal para a determinação de nitrogênio total e proteína bruta de tecidos, produtos e subprodutos de origem animal e vegetal.
Espectroscopia de Infravermelho Próximo, Método alternativo:
Embora o método de Kjeldahl seja confiável, amplamente utilizado e já exista uma forma de reduzir o impacto do método, existem dezenas de estudos que exploram outras técnicas alternativas por diversas questões, seja aumentar a rapidez da análise, reduzir o custo ou zerar o uso de reagentes.
A Espectroscopia de Infravermelho Próximo, também conhecida como NIR ou NIRS, é uma técnica que permite analisar principalmente amostras orgânicas (e algumas inorgânicas) através da emissão de radiação eletromagnética no infravermelho próximo de 780nm a 2500nm. Isso significa que ele pode fazer a análise de diversos parâmetros, e não só a de proteínas, o que fez com ele seja considerado uma das melhores formas de se analisar alimentos e outras amostras orgânicas.
Parâmetros como: Proteína, umidade, gordura, açúcares, glúten, cinzas, lactose e muito mais.
Além disso, já possuem diversos estudos de comparação com o Kjeldahl, tanto para análises alimentícias na determinação da proteína bruta, como em análises de nitrogênio em amostras de solo. Estudos mostram que os dois métodos produzem resultados idênticos, e que com o método NIRS a reprodutibilidade é superior ao método de Kjeldahl.
Veja um vídeo com a demonstração da análise de uma amostra de Carne:
Leia mais sobre o método NIR, neste artigo: O que é a Espectroscopia De Infravermelho Próximo (NIR)?
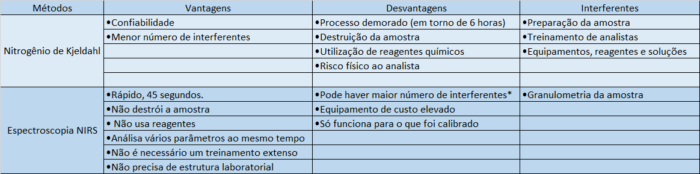
Tabela comparativa de métodos:
*Hoje com o uso da quimiometria grande parte dos interferentes são corrigidos pelo próprio software.
Aspectos positivos:
Rapidez: A análise é feita em cerca de 45 segundos, variando com o equipamento.
Analisa vários parâmetros: Um equipamento NIR pode analisar proteína, umidade, pH, lactose, glúten, cinzas, açúcares, porcentagem alcoólica e muitos outros parâmetros, em uma única análise.
Não precisa de preparo: A amostra não precisa de um preparo prévio, ela pode ser analisada da forma que ela estiver.
Não destrutivo: A amostra não é destruída durante a análise.
Sem reagentes: Não precisa de nenhum reagente ou padrão para a análise.
Não precisa de estrutura laboratorial: Não precisa de capela, equipamentos para digestão, gases ou qualquer outra estrutura, o equipamento NIR pode ficar mesmo em ambiente com vibrações e precisa apenas de uma fonte de energia para funcionar.
Você pode ver, por exemplo, como um equipamento NIR pode ser usado na análise de cerveja, do grão até o produto final, acessando este artigo: Controle de Qualidade Laboratorial Da Cerveja.
Além do NIR, existem outros métodos alternativos para determinação de Nitrogênio ou de proteínas, leia o artigo: Métodos Alternativos ao Kjeldahl para Análise de Nitrogênio e Proteínas.
Fontes:
A metodologia de preparo mencionada neste artigo veio da Embrapa Pantanal, do arquivo citado abaixo:
Adequação da Metodologia Kjeldahl para determinação de Nitrogênio Total e Proteína Bruta. Embrapa Pantanal. Disponível em: <https://ainfo.cnptia.embrapa.br/digital/bitstream/item/37465/1/CT63.pdf> Acesso em 02 de dezembro de 2022.
Melo, Claudia; et al. ESTUDO DA REDUÇÃO DE REAGENTES NA DETERMINAÇÃO DE PROTEINAS EM ALIMENTOS – MÉTODO DE KJELDAHL. CIÊNCIA E TECNOLOGIA DE ALIMENTOS, Uberaba, V. 6, p. 35-39, Jan/Jun, 2020. Disponível em: <https://periodicos.iftm.edu.br/index.php/inova/article/view/999#:~:text=Os%20m%C3%A9todos%20de%20determina%C3%A7%C3%A3o%20de,qu%C3%ADmica%2C%20al%C3%A9m%20dos%20custos%20operacionais.>. Acesso em: 05 de dezembro de 2022.
Viana, Valdomiro; Machado, Fábio. COMPARATIVO ENTRE OS MÉTODOS NITROGÊNIO DE KJELDAHL E NIRS PARA ANÁLISE DE PROTEÍNA BRUTA EM FARELO DE SOJA. Disponível em: <https://repositorio.uninter.com/bitstream/handle/1/798/VALDOMIRO%20TEIXEIRA%20VIANA.pdf?sequence=1&isAllowed=y>. Acesso em: 05 de dezembro de 2022.
Souza, Gilberto; et al. Avaliação da repetibilidade e reprodutibilidade de métodos de proteína bruta: estudo colaborativo. Congresso Brasileiro de Metrologia. 2015. Disponível em: <https://www.embrapa.br/busca-de-publicacoes/-/publicacao/1040044/avaliacao-da-repetibilidade-e-reprodutibilidade-de-metodos-de-proteina-bruta-estudo-colaborativo>. Acesso em: 05 de dezembro de 2022.